気体の法則
気体の法則

身体の中には、肺や空洞の部分がいろいろあって、
潜水すると圧力の影響を受け、
身体に何らかの影響を与えるので、
よく理解しておくことが必要だよ。

どんな、影響なのかな?
ダイビングのライセンスを取ったときに少し勉強したけど、
水中では息を止めてはいけないとか、
浮上(水中から海面に上がること)のときは、
ゆっくり浮上しなければならないとかのことですよね。

そうだよ。
その辺をこれから詳しく勉強するのよ。

はい。
ボイルの法則

まずは、大事な「ボイルの法則」を覚えようね。
ボイルの法則は、
「一定温度の気体の体積は圧力に反比例する。」 ということで、
圧力を2倍にすると体積は半分になる。
3倍にすると3分の1になるということなんだ。
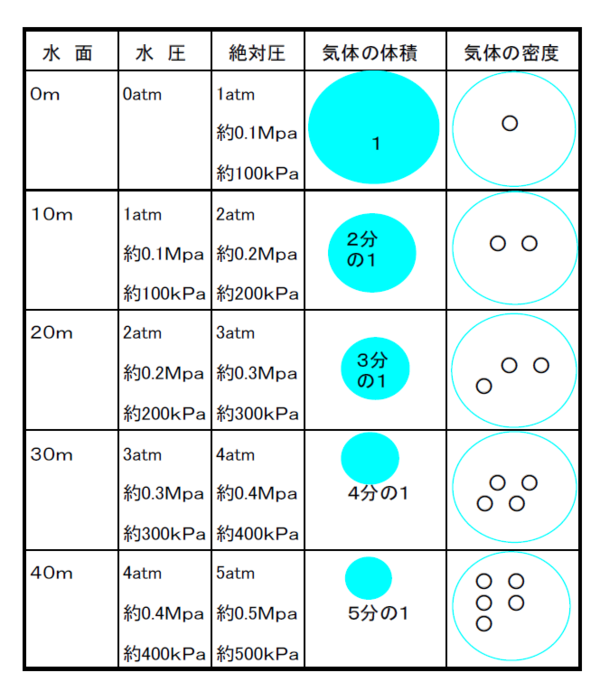
逆に考えると、圧力が弱まれば、
体積は増加するということだよね。
これが潜水には大事なんだ。

浮上するときには逆に膨らむということですね。

そうだね。
一応、計算式も頭に入れておいてね。(※1)
計算問題も出るからね。
潜水して、深いところに潜っていくと、
圧力によって人の肺や身体の中にある空気や
後で勉強するけど不活性ガスが体の中にぎゅっと閉じ込められるんだ。
閉じ込められた空気などは、浮上していくと、
圧力が弱まるので、どんどん膨張していくんだ。
ゆっくりと浮上して呼吸していれば問題はないけど、
いきなり速いスピードで浮上すると、
吐き出される空気の量よりも、膨張する空気のほうが大きくなって、
風船を膨らまし過ぎたように破裂しちゃうんだ。
※1
- 圧力をPとし、気体の体積をVとすると、次の式が成り立ちます。
V
P×V=2P×ーーーーー =P2×V2=一定
2

ダイビングのライセンスを取るとき、
肺の障害という勉強をしました。

そうね。
それだけじゃなくて、減圧症という病気にもなるから、
必ずゆっくりと浮上して、呼吸をとめちゃいけないんでしたね。
この障害については、高気圧障害というところで、
詳しく勉強しますね。
シャルルの法則

ボイルの法則で、気体の体積が変化することを勉強したけど、
気体の体積は、圧力のほかに温度にも影響を受けるよ。
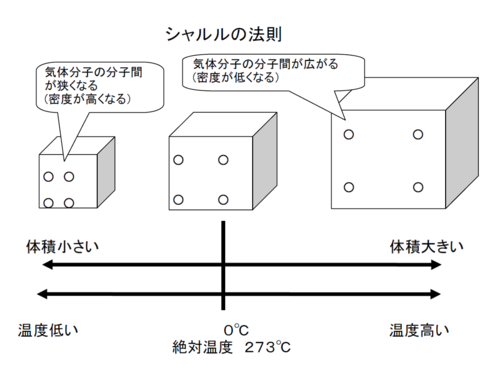
「シャルルの法則」とは、
「圧力一定のとき気体の体積は、絶対温度に比例する。」 ということで
絶対温度とは、簡単にいうと、気温0℃のことを、
別の単位で表すと、273.15℃という温度で、これを「絶対温度」というんだ。※2
※2
- 絶対温度をTとし、気体の体積をVとすると、次の式が成り立ちます。
V V2
ーーー = ーーー
T T2
- Tの絶対温度は、273.15℃のことで温度のひとつの単位のことで、プラスの20℃を絶対温度で表すと、273.15に20を加えた、293.15℃が絶対温度での表し方です。
「ボイル・シャルルの法則」

今、勉強した、ボイルの法則(圧力と体積の関係)では、
温度が一定という条件があり、
シャルルの法則(体積と温度の関係)は、
圧力が一定という条件が付いているよね。
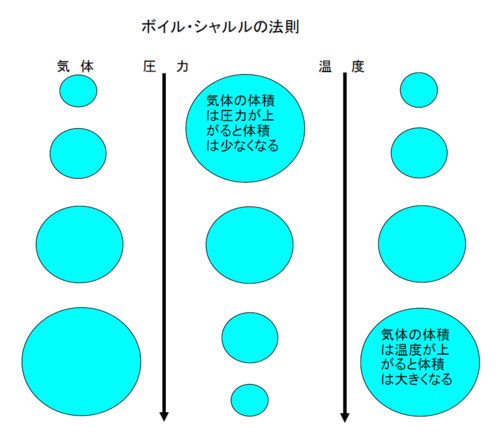
では、温度と圧力が一定ではなく、その両方が変化したときに
体積はどうのように変化するかというのを表したものが
「ボイル・シャルルの法則」で
「気体の体積は圧力に反比例し、温度に比例する。」
となります。※3
次の計算式を使って、
ボンベの圧力や内容量を求める計算問題がよく出るので、
次の ![[check]](image/face/check.png) 例題なども頭に入れておいてね。
例題なども頭に入れておいてね。
※3
- 圧力をV、絶対温度をTとし、気体の体積をVとすると、次の式が成り立ちます。
PV P2V2
ーーー = ーーー
T T2

![[check]](image/face/check.png) 例題:
例題:
スクーバ潜水において、10リットルのタンクに19.6MPa(メガパスカル)
まで空気を充填し、このときの空気温度が50℃であったとします。
このボンベを使用して、水温20℃の水に潜水した場合、ボンベは冷やされるので、
温度と圧力と体積の関係は、上の式から、次のように求められます。
圧力p=19.6MPa、温度T=273.15+50、体積10リットル
圧力P2、温度T2=273.15+20、体積10リットル
19.6×10(196) P2×10(10P2)
ーーーーーーーーーー = ーーーーーーーーーー
273.15+50(323.15) 273.15+20(293.15)
3231.5P2 = 574574
P2=17.780・・・となり、
温度の低下により、圧力は19.6MPaから約17.8MPaとなり
少なくなってしまうんだ。
逆に、温度が上昇すると圧力も上昇して、
ボンベの耐圧圧力を超えると破裂してしまうんだね。

炎天下にボンベを放置しないでねということを、
ライセンスを取るときに習ったのは、そういうことだったのね。

そうだよ。
次は、ちょっと難しくなるから、少し考えながら勉強してね。
「ダルトンの法則」

「2種類以上の気体からなる混合気体の圧力は(全圧)は、各成分気体の分圧の和に等しい。」※4
何のことだかよくわからないよね。

はい・・・

海野さんが呼吸している空気は、
実はいろいろな気体が
混ざりあってできているんだ。

いろいろな気体?
えっと、酸素とか窒素でしたよね。

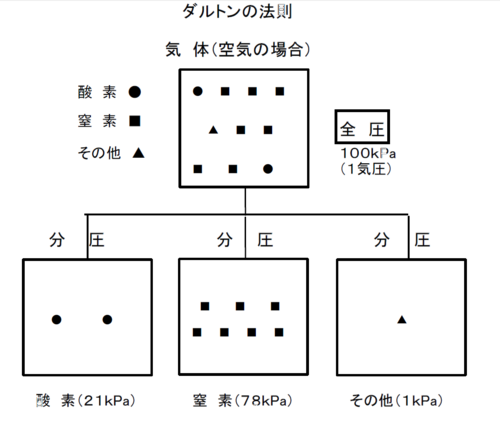
そう、空気は、酸素約21%、
窒素約78%、
その他(アルゴン、二酸化炭素など)約1%の混合気体で、
100%の空気となり、私達は100%の空気を呼吸して、
その中の酸素を体の中に取り入れているんだよ。

窒素とその他は吸っているけど、そのほとんどが、
そのまま吐き出されているのね。

そう考えてくれてもいいよ。
だけど、大事なことは、
この窒素という気体が潜水には、
いろいろと関わってくるやっかいな気体なんだ。
それはまたあとで勉強するけどね。
それで、100%の空気は、1気圧で100%の圧力から成り立っていて、
これを「全圧(全部の圧力)」というんだ。
100%の空気の中で、酸素だけの「分圧(分割された圧力)」は21、窒息は78、その他が1で、
合わせて100%の「全圧」になる。
ということは、それぞれの気体の「分圧」を合わせてやると、
空気で言えば100になるという法則なんだ。
潜水には、空気のほか、いろいろな混合ガスが使われるため、
ある気体の分圧が高くなると、身体に障害を与える場合があるので、
この「分圧」というものを覚えておくことが大事なことだからね。
※4
- 2種類以上の気体が混ざり合っている気体を混合気体(混合ガス)といい、それぞれのガスの分圧の和は混合気体の全圧と等しくなります。
- 呼吸している空気も物理上、実は混合気体で、ガスの割合(体積比)は、酸素をa、窒素をb、その他のガスをcとすると、
- 酸素(a)約21%、窒素(b)約78%、その他のガス(c)約1%です。
- ※(潜水では空気は、混合ガスではなく、空気は空気として扱います。)
- 酸素(a)約21%、窒素(b)約78%、その他のガス(c)約1%です。
- それぞれのガスの分圧は、酸素21kPa、窒素78kPa、その他のガス1kPaで1気圧(約100kPa)になります。
- これを式で表すと、混合ガスの全圧力(例として空気とする)をPとすると、P(全圧)=Pa(分圧)+Pb(分圧)+Pc(分圧)となり、
- 例えば、この空気を呼吸して水深30m(絶対圧では4気圧・400kPa)に潜水する場合、水深30m(4気圧)で呼吸する空気の各成分気体の分圧は、圧力が大きくなった分、次のようになります。
21
酸素分圧Pa=400kPa×ーーーー=84kPa
100(混合ガスの合計の%)
78
窒素分圧は、400kPa×ーーーー=312kPa
100
1
その他の分圧は、400kPa×ーーーー=4kPa
100
- 84+312+4=400
- 圧力が大きくなれば、各成分気体の分圧も増大します。
- ただし、空気に含まれる気体の割合は変化はしません。
- 圧力が大きくなれば、各成分気体の分圧も増大します。
- 窒素は、分圧が400kPaを超えると、窒素酔いと高気圧障害を引き起こすことがわかっています。この窒素の分圧が400kPaとなる圧力を考えてみると、
78
窒素分圧は、XkPa(圧力)×ーーーー=400kPa
100
- X = 約512kPa =5.12気圧
- 水深にすると、約41mとなります。ですから空気潜水では、現実的に水深約40mまでの潜水が限度となります。
- 水深にすると、約41mとなります。ですから空気潜水では、現実的に水深約40mまでの潜水が限度となります。
| 酸 素 | 窒 素 | その他 | ||||
| 割合% | 分 圧kPa | 割合% | 分 圧kPa | 割合% | 分 圧kPa | |
|---|---|---|---|---|---|---|
| 30kPaの空気 高い山など | 21 | 6.3 | 78 | 23.4 | 1 | 0.3 |
| 100kPaの空気 海面(1気圧) | 21 | 21 | 78 | 78 | 1 | 1 |
| 400kPaの空気 水深約30m | 21 | 84 | 78 | 312 | 1 | 4 |
| 512kPaの空気 水深約41m | 21 | 107 | 78 | 400 窒素酔い | 1 | 5 |
| 761kPaの空気 水深約66m | 21 | 160 酸素中毒 | 78 | 594 | 1 | 7 |
となります。

分圧ね。

次もちょっとわかりにくいかな?
「ヘンリーの法則」にいくね。

まだ、あるのか・・・・

がんばってね。
「ヘンリーの法則」

気体が液体に接しているときに、
気体は液体中に溶け込むんだ。
これを「溶解(分散)」と言っています。
「ヘンリーの法則」とは、
「温度が一定のとき、一定量の液体に溶解する気体の量は、その圧力(混合気体では分圧)に比例する。」と定められています。※5
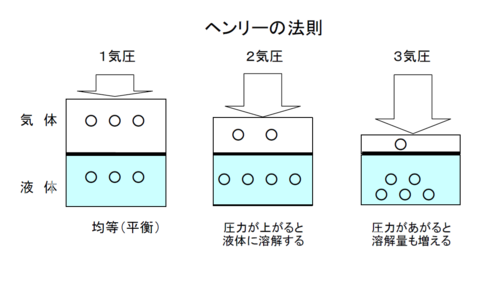
これを気体の量からではなく、体積からみると、
「一定量の溶媒に溶解する気体の体積は、その圧力下で測ると圧力に関係なく一定である。」とも定められています。

うー・・・
よくわからない・・・
※5
- 水深10メートル(200kPa、0.2MPa)においては、液体中に溶け込む気体の量は大気圧の2倍になり、20メートルでは、3倍になります。
- 気体は、液体中に無限大に溶解できるわけではなく、ある一定の限界があります。限度いっぱいまで溶解溶解した状態を「飽和」といい、後で出てくる「飽和潜水」にも関係が出てきます。
- 通常、大気圧下(100kPa、1atm)で生活している私たちの体の血液や組織の中には、例えば窒素は、78kPaで飽和していることになります。
- 逆に、圧力が下がると、飽和していた気体は溶け込める状態ではなくなるため、余剰分は液体中から気体へ排出されることになります。
- この飽和状態の均衡がくずれ余剰状態となった場合を「過飽和」といい、潜水で潜水した際、圧力の増加で、体内の血液や組織に溶解した気体が、浮上することで圧力が弱まり、過飽和になり、今度は、血液や組織から、肺を通じて呼吸によって水中に吐き出されます。
a:13421 t:6 y:9